- 荧光氨基酸传感器实时追踪细胞动态变化
- 来源:莱斯大学 发表于 2025/10/27
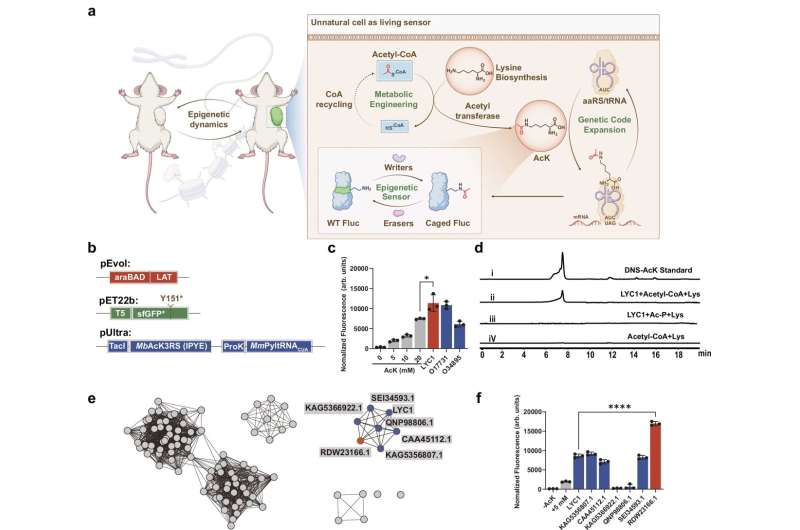
LAT 候选物筛选图。来源:《自然通讯》(2025 年),DOI:10.1038/s41467-025-64448-1
莱斯大学的研究人员通过基因工程改造活细胞,使其能利用第 21 种氨基酸实时发出荧光以标记蛋白质变化,为观测细胞内部动态提供了新方法。该技术在细菌、人类细胞及活体肿瘤模型中均能有效发挥作用,有望让癌症等复杂疾病的研究更具伦理可行性。
相关研究成果已发表于《自然通讯》期刊。
攻克生物学领域长期难题
这一突破解决了生物学领域长期存在的一项关键挑战:在活体内追踪蛋白质的细微变化 —— 即所谓的翻译后修饰(PTMs)。这类修饰如同 “开关”,调控着细胞生长、衰老、疾病发生等多种生理过程。研究团队并未采用破坏细胞或其他干扰性技术,而是通过基因工程让细胞合成一种具有荧光特性的赖氨酸;当上述 “开关” 被激活时,荧光信号可实时显现,为科学家观察生命活动的内在机制提供了全新视角。
“这套系统让我们得以看见活细胞内蛋白质的‘隐形舞蹈’。” 该研究的通讯作者、莱斯大学化学、生物工程与生物科学教授,同时也是德克萨斯州癌症预防与研究中心学者的肖涵(Han Xiao)表示,“通过为细胞配备合成并感知这种新型氨基酸的工具,我们打开了一扇直接观察翻译后修饰如何在活体动物中驱动生物学过程的窗口。”
发色团验证概念可行性
该研究的最初设想基于一个假设:让细胞具备自主合成并利用第 21 种氨基酸的能力,其效果将优于传统方法 —— 传统方法需向细胞提供大量人工合成的标记物。
研究团队首先筛选并利用特定酶,在细胞内部合成乙酰赖氨酸;随后通过基因工程改造细菌与人类细胞,使其能将乙酰赖氨酸精准整合到蛋白质的特定位点。当翻译后修饰发生(即修饰基团添加或移除)时,荧光蛋白或酶等报告蛋白会发出荧光,这一现象验证了该系统在实时追踪中的有效性。
“这种创新方法超越了以往的技术路径 —— 它无需添加外源化学物质,就能让我们观察到活细胞内蛋白质自然发生的变化。” 肖涵补充道。
翻译后修饰与癌症研究应用
为验证该技术的实用价值,研究人员利用这种传感器研究了去乙酰化酶 SIRT1—— 这是一种翻译后修饰调控因子,已知参与炎症调节,但其在癌症生物学中的作用长期存在争议。
实验发现,抑制 SIRT1 可阻断其酶活性,但与部分预期相反,这并未阻碍特定细胞系中的肿瘤生长。
“在活体组织内观察到乙酰化事件触发的荧光信号,这一过程令人振奋。” 肖涵表示,“它让原本不可见的蛋白质调控世界变得清晰可察,为研究疾病机制与药物作用开辟了新可能。”
广泛应用前景与未来展望
这种经基因工程改造的细胞,有望改变科学家在衰老、神经系统疾病等领域研究翻译后修饰的方式。由于该技术可在活体内发挥作用,因此能实时追踪疾病进展或治疗效果;同时,其基于荧光信号的检测方式,非常适合针对翻译后修饰调控酶开展大规模药物筛选。
未来,研究团队计划对该技术进行优化,将其应用于其他类型的翻译后修饰研究或人类来源的类器官系统,进一步提升该平台在个性化医疗领域的应用价值,并为深入理解细胞调控机制提供更多线索。
“借助这种活体传感器技术,我们的研究为观测翻译后修饰的动态变化提供了创新工具。它能将不可见的分子信号转化为可观测的生物学过程,有望重塑我们对蛋白质调控异常相关疾病的认知与治疗方式。” 该研究的第一作者、莱斯大学博士后研究员胡宇(Yu Hu)表示。
该研究的共同作者还包括莱斯大学的王艺贤(Yixian Wang)、程林奇(Linqi Cheng)、王辰航(Chenhang Wang)、刘艺杰(Yijie Liu)、王宇菲(Yufei Wang)、陈雨达(Yuda Chen)、杨舒丹(Shudan Yang)、郭一鸣(Yiming Guo)、姜世宇(Shiyu Jiang)及杨凯强(Kaiqiang Yang)。
期刊信息:《自然通讯》信息提供:莱斯大学
- 如果本文收录的图片文字侵犯了您的权益,请及时与我们联系,我们将在24内核实删除,谢谢!















